CJUE, 4e ch., 19 novembre 2020, n° C-663/18
COUR DE JUSTICE DE L’UNION EUROPEENNE
Arrêt
PARTIES
Demandeur :
B S, C A
Défendeur :
Ministère public, Conseil national de l’ordre des pharmaciens
COMPOSITION DE LA JURIDICTION
Président de chambre :
M. Vilaras
Juges :
M. Piçarra, M. Šváby, M. Rodin (rapporteur), Mme Jürimäe
Avocat général :
M. Tanchev
Avocats :
M. Pizarro, M. Metton, M. van Keymeulen, M. De Vallois, M. Vey, M. De Roux
LA COUR (quatrième chambre),
1 La demande de décision préjudicielle porte sur l’interprétation des articles 34 et 36 TFUE du règlement (UE) no 1307/2013 du Parlement européen et du Conseil, du 17 décembre 2013, établissant les règles relatives aux paiements directs en faveur des agriculteurs au titre des régimes de soutien relevant de la politique agricole commune et abrogeant le règlement (CE) no 637/2008 du Conseil et le règlement (CE) no 73/2009 du Conseil (JO 2013, L 347, p. 608), et du règlement (UE) no 1308/2013 du Parlement européen et du Conseil, du 17 décembre 2013, portant organisation commune des marchés des produits agricoles et abrogeant les règlements (CEE) no 922/72, (CEE) no 234/79, (CE) no 1037/2001 et (CE) no 1234/2007 du Conseil (JO 2013, L 347, p. 671).
2 Cette demande a été présentée dans le cadre d’une procédure pénale engagée en France contre B S et C A, au sujet de la commercialisation et de la distribution d’une cigarette électronique à l’huile de chanvre.
Le cadre juridique
Le droit international
Le SH et les notes explicatives du SH
– Le SH
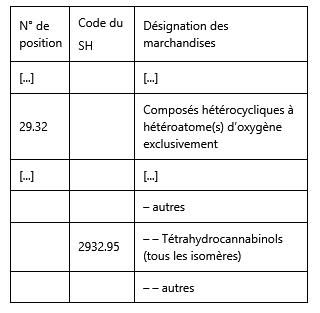
3 Le Conseil de coopération douanière, devenu l’Organisation mondiale des douanes (OMD), a été institué par la convention portant création d’un conseil de coopération douanière, conclue à Bruxelles le 15 décembre 1950. Le système harmonisé de désignation et de codification des marchandises (ci-après le « SH ») a été élaboré par l’OMD et institué par la convention internationale sur le système harmonisé de désignation et de codification des marchandises, conclue à Bruxelles le 14 juin 1983 et approuvée, avec son protocole d’amendement du 24 juin 1986, au nom de la Communauté économique européenne, par la décision 87/369/CEE du Conseil, du 7 avril 1987 (JO 1987, L 198, p. 1) (ci-après la « convention sur le SH »).
4 La position 2932 de la nomenclature du SH qui figure au chapitre 29 de celle-ci, intitulé « Produits chimiques organiques », se présente comme suit :
5 Relève de la position 5701 de la nomenclature du SH, devenue la position 5302 de celle-ci, le « Chanvre (Cannabis sativa L.) brut ou travaillé mais non filé ; étoupes et déchets de chanvre (y compris les déchets de fils et les effilochés) ».
– Les notes explicatives du SH
6 Les notes explicatives du SH sont élaborées au sein de l’OMD conformément aux dispositions de la convention sur le SH.
7 La note relative au chapitre 29 de la nomenclature du SH indique :
« Le Chapitre 29 ne comprend, en principe, que des composés de constitution chimique définie présentés isolément [...] Un composé de constitution chimique définie présenté isolément est une substance constituée par une espèce moléculaire (covalente ou ionique, notamment) dont la composition est définie par un rapport constant entre ses éléments et qui peut être représentée par un diagramme structural unique. [...] Ces composés peuvent contenir des impuretés. »
8 Selon la note relative à la position 5302 de la nomenclature du SH, cette position couvre :
« 1) Le chanvre brut, tel qu’il provient de l’arrachage, égrené ou non.
2) Le chanvre roui, dont les fibres, décollées partiellement de la chènevotte, adhèrent encore à celle-ci.
3) Le chanvre teillé, c’est-à-dire la filasse seule, constituée par des faisceaux de fibres (filaments textiles) excédant parfois 2 m de longueur.
4) La filasse de chanvre peignée ou autrement traitée pour le filage (mais non filée), présentée ordinairement sous forme de rubans ou de mèches.
5) Les étoupes et déchets filamenteux de chanvre, qui proviennent en général du teillage et surtout du peignage, ainsi que les déchets de fils de chanvre, recueillis notamment au cours du filage ou du tissage et les effilochés de chanvre, obtenus par effilochage de vieux cordages, de chiffons, etc. Ces déchets sont compris ici, qu’ils soient utilisables en filature (ils peuvent alors être présentés sous forme de rubans ou de mèches) ou non ; dans ce dernier cas, ils sont employés, par exemple, comme matériaux de rembourrage ou de calfatage ou pour la fabrication du papier. »
La convention unique
9 La convention unique sur les stupéfiants de 1961 telle que modifiée par le protocole de 1972 portant amendement de la convention unique sur les stupéfiants de 1961, conclue à New York le 30 mars 1961 (Recueil des traités des Nations unies, vol. 520, no 7515, ci-après la « convention unique »), prévoit, à son article 1er :
« 1. Sauf indication expresse en sens contraire ou sauf si le contexte exige qu’il en soit autrement, les définitions ci-après s’appliquent à toutes les dispositions de la présente Convention :
[...]
b) Le terme “cannabis” désigne les sommités florifères ou fructifères de la plante de cannabis (à l’exclusion des graines et des feuilles qui ne sont pas accompagnées des sommités) dont la résine n’a pas été extraite, quelle que soit leur application.
c) L’expression “plante de cannabis” désigne toute plante du genre cannabis.
[...]
j) Le terme “stupéfiant” désigne toute substance des Tableaux I et II,
qu’elle soit naturelle ou synthétique.
[...] »
10 La liste des stupéfiants du tableau I de la même convention comprend le cannabis, la résine de cannabis, les extraits et teintures de cannabis.
La convention sur les substances psychotropes
11 La convention de 1971 sur les substances psychotropes, conclue à Vienne le 21 février 1971 (Recueil des traités des Nations unies, vol. 1019, no 14956, ci-après la « convention sur les substances psychotropes »), prévoit, à son article 1er, sous e) :
« Sauf indication expresse en sens contraire, ou sauf si le contexte exige qu’il en soit autrement, les expressions suivantes ont dans la présente Convention les significations indiquées ci-dessous :
[...]
e) L’expression “substance psychotrope” désigne toute substance, qu’elle soit d’origine naturelle ou synthétique, ou tout produit naturel du Tableau I, II, III ou IV [de la présente convention]. »
Le droit de l’Union
La décision-cadre 2004/757/JAI
12 La décision-cadre 2004/757/JAI du Conseil, du 25 octobre 2004, concernant l’établissement des dispositions minimales relatives aux éléments constitutifs des infractions pénales et des sanctions applicables dans le domaine du trafic de drogue (JO 2004, L 335, p. 8), prévoit, à son article 1er :
« Aux fins de la présente décision-cadre, on entend par :
1) “drogue” toutes les substances visées par les conventions des Nations unies suivantes :
a) la [convention unique] ;
b) la [convention sur les substances psychotropes]. Sont également visées les substances mises sous contrôle dans le cadre de l’action commune 97/396/JAI[,] du 16 juin 1997[, fondée sur l’article K 3 du traité sur l’Union européenne] relative à l’échange d’informations, à l’évaluation des risques et au contrôle des nouvelles drogues de synthèse [(JO 1997, L 167, p. 1)]. »
13 Aux termes de l’article 2, paragraphe 1, sous a), de la décision-cadre 2004/757, chaque État membre prend les mesures nécessaires pour que les comportements intentionnels suivants soient punis lorsqu’ils ne peuvent être légitimés : la production, la fabrication, l’extraction, la préparation, l’offre, la mise en vente, la distribution, la vente, la livraison à quelque condition que ce soit, le courtage, l’expédition, l’expédition en transit, le transport, l’importation ou l’exportation de drogues. L’article 2, paragraphe 2 de cette décision-cadre précise que les comportements décrits à l’article 2, paragraphe 1, de celle-ci ne sont pas inclus dans le champ d’application de ladite décision-cadre lorsque leurs auteurs s’y livrent exclusivement à des fins de consommation personnelle telle que définie par la législation nationale.
La convention d’application de l’accord de Schengen
14 La convention d’application de l’accord de Schengen, du 14 juin 1985, entre les Gouvernements des États de l’Union économique Benelux, de la République fédérale d’Allemagne et de la République française relatif à la suppression graduelle des contrôles aux frontières communes (JO 2000, L 239, p. 19), signée à Schengen le 19 juin 1990 et entrée en vigueur le 26 mars 1995, ci-après la « convention d’application de l’accord de Schengen », fait partie de l’acquis de Schengen, tel que visé à l’article 1er, paragraphe 2, de la décision 1999/435/CE du Conseil, relative à la définition de l’acquis de Schengen en vue de déterminer, conformément aux dispositions pertinentes du traité instituant la Communauté européenne et du traité sur l’Union européenne, la base juridique de chacune des dispositions ou décisions qui constituent l’acquis du 20 mai 1999 (JO 1999, L 176, p. 1).
15 L’article 71, paragraphe 1, de cette convention d’application dispose que les parties contractantes s’engagent, en ce qui concerne la cession directe ou indirecte de stupéfiants et de substances psychotropes de quelque nature que ce soit, y compris le cannabis, ainsi que la détention de ces produits et substances aux fins de cession ou d’exportation, à prendre, en conformité avec les conventions existantes des Nations unies, toutes mesures nécessaires à la prévention et à la répression du trafic illicite des stupéfiants et des substances psychotropes.
Le règlement n° 1307/2013
16 L’article 1er, paragraphe 1, sous a), du règlement n° 1307/2013 prévoit :
« Le présent règlement établit :
a) des règles communes relatives aux paiements octroyés directement aux agriculteurs au titre des régimes de soutien énumérés à l’annexe I (“paiements directs”) ».
17 Aux termes de l’article 4, paragraphe 1, sous d), de ce règlement :
« Aux fins du présent règlement, on entend par :
[...]
d) “produits agricoles”, les produits, à l’exclusion des produits de la pêche, énumérés à l’annexe I des traités, et le coton ».
18 L’article 32, paragraphe 6, dudit règlement dispose :
« Les surfaces utilisées pour la production de chanvre ne sont des hectares admissibles que si les variétés cultivées ont une teneur en tétrahydrocannabinol n’excédant pas 0,2 %. »
19 L’article 35, paragraphe 3, du même règlement prévoit :
« Afin de préserver la santé publique, la Commission [européenne] est habilitée à adopter des actes délégués en conformité avec l’article 70, visant à fixer les règles subordonnant l’octroi des paiements à l’utilisation de semences certifiées de certaines variétés de chanvre et à fixer la procédure relative à la détermination des variétés de chanvre et à la vérification de leur teneur en tétrahydrocannabinol visée à l’article 32, paragraphe 6. »
Le règlement n° 1308/2013
20 L’article 1er, paragraphes 1 et 2, du règlement n° 1308/2013 dispose :
« 1. Le présent règlement établit une organisation commune des marchés pour les produits agricoles, c’est-à-dire tous les produits énumérés à l’annexe I des traités, à l’exclusion des produits de la pêche et de l’aquaculture définis dans les actes législatifs de l’Union sur l’organisation commune des marchés des produits de la pêche et de l’aquaculture.
2. Les produits agricoles définis au paragraphe 1 sont répartis dans les secteurs suivants énumérés dans les parties respectives de l’annexe I :
[...]
h) lin et chanvre, partie VIII ;
[...] »
21 L’annexe I, partie VIII, de ce règlement mentionne dans la liste des produits visés à l’article 1er, paragraphe 2, de celui-ci notamment le « Chanvre (Cannabis sativa L.) brut ou travaillé mais non filé ; étoupes et déchets de chanvre (y compris les déchets de fils et les effilochés) ».
22 L’article 189 dudit règlement, comportant des dispositions particulières relatives aux importations de chanvre, dispose :
« 1. Les produits suivants ne peuvent être importés dans l’Union [européenne] que si les conditions suivantes sont remplies :
a) le chanvre brut relevant du code NC 5302 10 00 répond aux conditions établies à l’article 32, paragraphe 6, et à l’article 35, paragraphe 3, du règlement [no 1307/2013] ;
b) les graines destinées à l’ensemencement de variétés de chanvre, relevant du code NC ex 1207 99 20, accompagnées de la preuve que le taux de tétrahydrocannabinol de la variété concernée n’est pas supérieur à celui fixé conformément à l’article 32, paragraphe 6, et à l’article 35, paragraphe 3, du règlement [no 1307/2013] ;
c) les graines de chanvre autres que celles destinées à l’ensemencement, relevant du code NC 1207 99 91, ne sont importées que par des importateurs agréés par l’État membre de façon à garantir que leur destination n’est pas l’ensemencement.
2. Le présent article s’applique sans préjudice des dispositions plus restrictives prises par les États membres, dans le respect du traité[ FUE] et des obligations découlant de l’[accord sur l’agriculture (JO 1994, L 336, p. 22), figurant à l’annexe 1 A de l’accord instituant l’Organisation mondiale du commerce (JO 1994, L 336, p. 3), approuvé au nom de la Communauté européenne par l’article 1er, paragraphe 1, premier tiret, de la décision 94/800/CE du Conseil, du 22 décembre 1994, relative à la conclusion au nom de la Communauté européenne, pour ce qui concerne les matières relevant de ses compétences, des accords des négociations multilatérales du cycle de l’Uruguay (1986-1994) (JO 1994, L 336, p. 1)]. »
Le droit français
Le code de la santé publique
23 L’article L. 5132-1 du code de la santé publique, dans sa version applicable au litige au principal (ci-après le « code de la santé publique »), dispose :
« Sont comprises comme substances vénéneuses :
[…]
2° Les substances stupéfiantes ;
3° Les substances psychotropes ;
[…]
On entend par “substances” les éléments chimiques et leurs composés comme ils se présentent à l’état naturel ou tels qu’ils sont produits par l’industrie, contenant éventuellement tout additif nécessaire à leur mise sur le marché.
[...] »
24 L’article L. 5132-8, premier alinéa, du code de la santé publique dispose :
« La production, la fabrication, le transport, l’importation, l’exportation, la détention, l’offre, la cession, l’acquisition et l’emploi de plantes, de substances ou de préparations classées comme vénéneuses sont soumises à des conditions définies par décrets en Conseil d’État [(France)]. »
25 L’article R. 5132-86, paragraphes 1 et 2, du code de la santé publique dispose :
« I. – Sont interdits la production, la fabrication, le transport, l’importation, l’exportation, la détention, l’offre, la cession, l’acquisition ou l’emploi :
1° Du cannabis, de sa plante et de sa résine, des produits qui en contiennent ou de ceux qui sont obtenus à partir du cannabis, de sa plante ou de sa résine ;
2° Des tétrahydrocannabinols, à l’exception du delta9-tétrahydrocannabinol, de leurs esters, éthers, sels ainsi que des sels des dérivés précités et de produits qui en contiennent.
II. – Des dérogations aux dispositions énoncées ci-dessus peuvent être accordées aux fins de recherche et de contrôle ainsi que de fabrication de dérivés autorisés par le directeur général de l’Agence nationale de sécurité du médicament et des produits de santé.
La culture, l’importation, l’exportation et l’utilisation industrielle et commerciale de variétés de cannabis dépourvues de propriétés stupéfiantes ou de produits contenant de telles variétés peuvent être autorisées, sur proposition du directeur général de l’agence, par arrêté des ministres chargés de l’agriculture, des douanes, de l’industrie et de la santé. »
L’arrêté du 22 août 1990
26 L’article 1er de l’arrêté du 22 août 1990, portant application de l’article R. 5132-86 du code de la santé publique pour le cannabis (JORF du 4 octobre 1990, p. 12041), dans sa version applicable au litige au principal (ci-après l’« arrêté du 22 août 1990 »), dispose :
« Au sens de l’article R. 5181 du code susvisé, sont autorisées la culture, l’importation, l’exportation et l’utilisation industrielle et commerciale (fibres et graines) des variétés de Cannabis sativa L. répondant aux critères suivants :
– la teneur en delta-9-tétrahydrocannabinol de ces variétés n’est pas supérieure à 0,20 % ;
– la détermination de la teneur en delta-9-tétrahydrocannabinol et la prise d’échantillons en vue de cette détermination sont effectuées selon la méthode [de l’Union] prévue en annexe.
[…] »
La circulaire du 23 juillet 2018
27 Dans la circulaire du ministère de la Justice, du 23 juillet 2018, ayant pour objet le régime juridique applicable aux établissements proposant à la vente au public des produits issus du cannabis (coffee shops) (2018/F/0069/FD2) (ci-après la « circulaire du 23 juillet 2018 »), l’arrêté du 22 août 1990 est interprété comme suit :
« La culture du chanvre, son importation, son exportation et son utilisation ne sont ainsi autorisées que si :
– la plante est issue de l’une des variétés de cannabis sativa L. prévues par l’arrêté [du 22 août 1990],
– seules les fibres et graines de la plante sont utilisées,
– la plante contient elle-même moins de 0,20 % de delta9-tétrahydrocannabinol.
Contrairement à l’argument parfois opposé par les établissements offrant à la vente des produits à base de cannabidiol, la teneur autorisée en delta9-tétrahydrocannabinol de 0,20 % s’applique à la plante de cannabis et non pas au produit fini qui en serait issu.
[…]
Il convient de préciser que le cannabidiol se trouve principalement dans les feuilles et dans les fleurs de la plante, et non dans les fibres et graines. Par conséquent, en l’état de la législation applicable, l’extraction du cannabidiol dans des conditions conformes au code de la santé publique ne paraît pas possible.
[…] »
Le litige au principal et la question préjudicielle
28 B S et C A sont les anciens dirigeants de Catlab SAS, une société créée en 2014 pour la commercialisation du Kanavape, de kits alpha-cat pour analyser la qualité du cannabidiol (CBD) et de l’huile de chanvre. Le Kanavape est une cigarette électronique dont le liquide contient du CBD, dont la distribution devait s’effectuer par Internet et un réseau de vendeurs de cigarettes électroniques. Le CBD est généralement extrait du « cannabis sativa » ou « chanvre » dans la mesure où cette variété en contient naturellement un taux élevé, comme elle contient un faible taux de tétrahydrocannabinol (ci-après le « THC »).
29 Le CBD utilisé dans le Kanavape a été produit en République tchèque en utilisant la plante de cannabis sativa dans son intégralité, laquelle avait également été cultivée sur place. Il a été importé en France par Catlab qui l’a conditionné dans des cartouches de cigarettes électroniques.
30 À la suite d’une campagne de communication pour promouvoir le lancement du Kanavape conduite par Catlab en 2014, une enquête a été ouverte et l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a été saisie.
31 Le laboratoire de l’ANSM a analysé des cartouches de Kanavape présentes sur le marché et, si des écarts notables avaient pu être constatés quant à la teneur en CBD de ces cartouches, le taux de THC présent dans les produits examinés était toujours inférieur au seuil légalement autorisé. Au mois de juillet 2016, à la suite de la réunion de sa commission des stupéfiants et des psychotropes, l’ANSM a fait savoir qu’elle ne considérait pas le Kanavape comme un « médicament ».
32 Par un jugement du 8 janvier 2018, le tribunal correctionnel de Marseille (France), a, notamment, déclaré B S et C A coupables de plusieurs chefs d’infraction, dont des chefs d’infraction à la législation relative aux substances vénéneuses. Les requérants au principal ont été condamnés, respectivement, à 18 et à 15 mois d’emprisonnement avec sursis ainsi qu’à 10 000 euros d’amende chacun. Sur le plan civil, ils ont été condamnés solidairement à payer 5 000 euros en réparation du préjudice subi par le Conseil national de l’ordre des pharmaciens (CNOP) et 600 euros en application du code de procédure pénale.
33 Les requérants au principal ont interjeté appel de ce jugement devant la cour d’appel d’Aix-en-Provence (France), respectivement le 11 et le 12 janvier 2018. Devant la juridiction de renvoi, ils soutiennent, en particulier, que l’interdiction de la commercialisation du CBD issu de la plante de cannabis sativa dans son intégralité est contraire au droit de l’Union.
34 La juridiction de renvoi explique que le CBD n’apparaît pas avoir des « effets psychoactifs reconnus ». En effet, elle note que l’Organisation mondiale de la santé (OMS) a, dans un rapport de l’année 2017, recommandé de le retirer de la liste des produits dopants, que le CBD n’est pas répertorié en tant que tel par la convention unique, que l’ANSM a conclu, le 25 juin 2015, à l’absence de données suffisantes pour le classer comme étant « nocif » et, enfin, que l’expert désigné dans le cadre de l’enquête pénale qui a donné lieu aux poursuites engagées contre les requérants au principal a conclu qu’il avait un « effet sur le système nerveux central faible ou nul ». En outre, le CBD n’est expressément visé ni dans les textes qui ont vocation à s’appliquer au chanvre industriel ni dans ceux relatifs au cannabis stupéfiant.
35 Néanmoins, dès lors que le CBD présent dans le Kanavape est issu de la plante de cannabis sativa dans son intégralité, celui-ci doit être considéré comme un produit issu des parties de cette plante autres que les graines et les fibres, dont la commercialisation, selon l’article 1er de l’arrêté du 22 août 1990, tel qu’interprété par la circulaire du 23 juillet 2018, n’est pas autorisée.
36 Dans ce contexte, la juridiction de renvoi s’interroge sur la conformité de cette disposition avec le droit de l’Union, considérant que le « chanvre (cannabis sativa) brut, roui, teillé, peigné ou autrement traité mais non filé ; étoupes et déchets (y compris effilochés) » figure dans le chapitre 57 de la nomenclature du SH à laquelle il est fait référence à l’annexe I des traités et que, par conséquent, il devrait être considéré comme un produit agricole, au sens de l’article 38 TFUE, qui met en place un marché intérieur fondé sur la libre circulation des marchandises.
37 Il lui semble que, dans la mesure où le taux de THC dans le chanvre commercialisé légalement dans les autres États membres est inférieur à 0,2 %, comme c’est le cas dans l’affaire au principal, le CBD ne peut être qualifié de « stupéfiant ». En effet, selon les arrêts du 26 octobre 1982, Wolf (221/81, EU:C:1982:363), ainsi que du 28 mars 1995, Evans Medical et Macfarlan Smith (C‑324/93, EU:C:1995:84), seul le produit dont la nocivité est démontrée ou généralement reconnue et dont l’importation et la commercialisation est interdite dans tous les États membres peut revêtir une telle qualification.
38 En outre, la juridiction de renvoi considère que les règlements nos 1307/2013 et 1308/2013 sont applicables au chanvre.
39 Par ailleurs, si l’article 189 du règlement n° 1308/2013 autorise l’importation du chanvre brut sous certaines conditions et fixe des limitations relatives à certaines graines, cet article 189 « s’applique sans préjudice des dispositions plus restrictives prises par les États membres, dans le respect du traité [FUE] et des obligations découlant de l’[accord sur l’agriculture, figurant à l’annexe 1 A de l’accord instituant l’Organisation mondiale du commerce] ».
40 À cet égard, il apparaît à la juridiction de renvoi que les conditions cumulatives posées par la Cour pour considérer une mesure nationale « plus restrictive », au sens dudit article 189, comme étant conforme au traité FUE ne sont pas remplies.
41 En effet, l’objectif de santé publique lui semble déjà pris en considération dans le règlement no 1308/2013 dans la mesure où ce règlement limite son champ d’application aux seules variétés offrant des garanties en ce qui concerne la teneur en substances inébriantes et où il fixe, d’une part, une limitation relative aux graines et, d’autre part, un taux de 0,2 % pour la teneur en THC du chanvre.
42 En outre, le principe de proportionnalité ne lui paraît pas susceptible d’être invoqué dans la mesure où, dans la circulaire du 23 juillet 2018, la République française se prévaut, pour justifier l’interdiction du CBD d’origine naturelle, d’une prohibition qui ne pourrait s’étendre à la commercialisation d’un CBD de synthèse aux caractéristiques et effets identiques.
43 Dans ces conditions, la cour d’appel d’Aix-en-Provence a décidé de surseoir à statuer et de poser à la Cour la question préjudicielle suivante :
« [L]es règlements nos 1307/2013 et 1308/2013, ainsi que le principe de libre circulation des marchandises, doivent-ils être interprétés de telle sorte que les dispositions dérogatoires instituées par l’arrêté du 22 août 1990 édictent, en limitant la culture du chanvre, son industrialisation et sa commercialisation, aux seules fibres et graines, une restriction non conforme au droit [de l’Union] ? »
Sur la question préjudicielle
44 Si la juridiction de renvoi vise, dans le libellé de sa question, la limitation de « la culture du chanvre, son industrialisation et sa commercialisation, aux seules fibres et graines », il ressort de ses propres explications que la question posée ne saurait présenter une pertinence pour l’affaire au principal qu’en tant qu’elle vise la conformité au droit de l’Union d’une réglementation nationale qui interdit la commercialisation du CBD lorsque celui-ci est extrait de la plante de cannabis sativa dans son intégralité et non de ses seules fibres et graines.
45 Il y a, dès lors, lieu de considérer que, par sa question, la juridiction de renvoi demande, en substance, si les règlements nos 1307/2013 et 1308/2013 ainsi que les articles 34 et 36 TFUE doivent être interprétés en ce sens qu’ils s’opposent à une règlementation nationale dans la mesure où elle interdit la commercialisation du CBD lorsque celui-ci est extrait de la plante de cannabis sativa dans son intégralité et non de ses seules fibres et graines.
Sur l’interprétation des règlements nos 1307/2013 et 1308/2013
46 Le champ d’application du règlement no 1308/2013 est défini à l’article 1er, paragraphe 1, de celui-ci comme établissant une organisation commune des marchés pour les produits agricoles, c’est-à-dire tous les produits énumérés à l’annexe I des traités, à l’exclusion des produits de la pêche et de l’aquaculture définis dans les actes législatifs de l’Union sur l’organisation commune des marchés des produits de la pêche et de l’aquaculture.
47 Lorsque les dispositions du règlement no 1307/2013 font référence aux produits agricoles, elles visent, selon l’article 4, paragraphe 1, sous d), de celui-ci, les produits, à l’exclusion des produits de la pêche, énumérés à l’annexe I des traités, et le coton.
48 À cet égard, il convient de préciser que l’annexe I des traités, à laquelle renvoient ces dispositions, comporte, notamment, une référence à la position 5701 de la nomenclature du SH, devenue la position 5302 de celle-ci. Relève de cette position le « chanvre (Cannabis sativa) brut, roui, teillé, peigné ou autrement traité, mais non filé ; étoupes et déchets, y compris les effilochés ».
49 Selon les notes explicatives du SH, qui contribuent de façon importante à l’interprétation de la portée des différentes positions tarifaires, sans toutefois avoir force obligatoire de droit (arrêt du 13 septembre 2018, Vision Research Europe, C‑372/17, EU:C:2018:708, point 23), la position 5302 couvre « le chanvre brut, tel qu’il provient de l’arrachage, égrené ou non », « le chanvre roui, dont les fibres, décollées partiellement de la chènevotte, adhèrent encore à celle-ci », « le chanvre teillé, c’est-à-dire la filasse seule, constituée par des faisceaux de fibres (filaments textiles) excédant parfois 2 m de longueur », « la filasse de chanvre peignée ou autrement traitée pour le filage (mais non filée), présentée ordinairement sous forme de rubans ou de mèches » et « les étoupes et déchets filamenteux de chanvre ».
50 C A a soutenu, sans être contredit par les autres intéressés dans la procédure devant la Cour, que le CBD en cause au principal était extrait de la plante de cannabis sativa dans son intégralité par le procédé d’extraction par dioxyde de carbone (CO2).
51 Ainsi, ce produit ne constitue, ainsi que M. l’avocat général l’a relevé au point 35 de ses conclusions, ni du chanvre brut, dès lors qu’il ne provient pas de l’arrachage, ni du chanvre roui ou teillé, ou la filasse, dès lors que le procédé d’extraction n’implique pas la séparation des fibres du reste de la plante.
52 Contrairement à ce que les requérants au principal font valoir, il y a lieu par conséquent de considérer que le CBD extrait de la plante de cannabis sativa dans son intégralité ne saurait être considéré comme relevant de la position 5701 de la nomenclature du SH, devenue position 5302 de celle-ci, visée à l’annexe I des traités.
53 Cela étant, il y a lieu d’observer que le chapitre 29 de la nomenclature du SH comprend les produits chimiques organiques et que la position 2932 de celle-ci reprend les composés hétérocycliques à hétéroatome(s) d’oxygène exclusivement, dont relève notamment le THC, un cannabinoïde tel que le CBD.
54 Selon les notes explicatives du SH, relèvent du chapitre 29 de la nomenclature du SH des composés de constitution chimique définie présentés isolément, ces composés étant des substances constituées par une espèce moléculaire dont la composition est définie par un rapport constant entre ses éléments, pouvant être représentées par un diagramme structural unique et pouvant contenir des impuretés.
55 Ainsi, dans la mesure où le produit en cause au principal est présenté de telle manière qu’il ne comprend aucun autre composé que le CBD, hormis des impuretés, il relève de la position 2932 de la nomenclature du SH.
56 Il découle de ce qui précède que la liste des produits agricoles visés à l’annexe I des traités ne mentionnant pas la position 2932 de la nomenclature du SH, le CDB présent dans la plante de cannabis sativa dans son intégralité ne saurait être considéré comme un produit agricole et, partant, ne saurait être considéré comme un produit visé par les règlements nos 1307/2013 et 1308/2013.
57 En effet, ainsi que M. l’avocat général l’a relevé au point 36 de ses conclusions, seuls les produits figurant à l’article 4, paragraphe 1, sous d), du règlement no 1307/2013 et à l’article 1er, paragraphe 1, du règlement no 1308/2013 sont visés par ceux-ci.
58 Dans ces conditions, il convient de conclure que les règlements nos 1307/2013 et 1308/2013 doivent être interprétés en ce sens qu’ils ne s’appliquent pas au CBD.
Sur l’interprétation des articles 34 et 36 TFUE
59 À titre liminaire, il y a lieu de rappeler que la nocivité des stupéfiants, y compris ceux à base de chanvre, tels que le cannabis, étant généralement reconnue, leur commercialisation est interdite dans tous les États membres, exception faite d’un commerce strictement contrôlé en vue d’une utilisation à des fins médicales et scientifiques (arrêt du 16 décembre 2010, Josemans, C‑137/09, EU:C:2010:774, point 36).
60 Cette situation juridique est conforme à différents instruments internationaux auxquels les États membres ont coopéré ou adhéré, tels que la convention unique et la convention sur les substances psychotropes. Les mesures prévues par celles-ci ont, par la suite, été renforcées et complétées par la convention des Nations unies contre le trafic illicite de stupéfiants et de substances psychotropes, conclue à Vienne le 20 décembre 1988 (Recueil des traités des Nations unies, vol. 1582, no 1-27627), à laquelle tous les États membres ainsi que l’Union sont parties. Ladite situation juridique est également justifiée au regard du droit de l’Union et, plus particulièrement de la décision-cadre 2004/757 et de l’article 71, paragraphe 1, de la convention d’application de l’accord de Schengen (voir, en ce sens, arrêt du 16 décembre 2010, Josemans, C‑137/09, EU:C:2010:774, points 37 à 40).
61 Il en résulte que les stupéfiants qui ne se trouvent pas dans un circuit strictement surveillé par les autorités compétentes en vue d’être utilisés à des fins médicales et scientifiques relèvent, par leur nature même, d’une interdiction d’importation et de mise en vente sur le territoire de tous les États membres (arrêt du 16 décembre 2010, Josemans, C‑137/09, EU:C:2010:774, point 41).
62 L’introduction de stupéfiants qui ne relèvent pas d’un tel circuit strictement surveillé, dans le circuit économique et commercial de l’Union, étant interdite, des personnes qui commercialisent ces produits ne sauraient se prévaloir de l’application des libertés de circulation ou du principe de non-discrimination, en ce qui concerne l’activité consistant en la commercialisation de cannabis (arrêt du 16 décembre 2010, Josemans, C‑137/09, EU:C:2010:774, point 42).
63 Il convient, dès lors, de déterminer si le CBD en cause au principal constitue un stupéfiant, au sens de la jurisprudence citée aux points 59 à 62 du présent arrêt.
64 À cet égard, il convient de relever que cette substance n’est pas visée par la convention sur les substances psychotropes ni par l’action commune 97/396, auxquelles il est fait référence à l’article 1er, point 1, sous b), de la décision‑cadre 2004/757.
65 Ainsi, il convient de déterminer si le CBD en cause au principal est visé par la convention unique à laquelle il est fait référence à l’article 1er, point 1, sous a), de la décision‑cadre 2004/757 et qui est également visée à l’article 71, paragraphe 1, de la convention d’application de l’accord de Schengen.
66 S’agissant de l’interprétation d’une convention internationale, telle que la convention unique, il convient de rappeler que, conformément à une jurisprudence constante, un traité international doit être interprété en fonction des termes dans lesquels il est rédigé ainsi qu’à la lumière de ses objectifs. Les articles 31 de la convention de Vienne, du 23 mai 1969, sur le droit des traités (Recueil des traités des Nations unies, vol. 1155, p. 331), et, de la convention de Vienne, du 21 mars 1986, sur le droit des traités entre États et organisations internationales ou entre organisations internationales (Documents officiels de la Conférence des Nations unies sur le droit des traités entre États et organisations internationales ou entre organisations internationales, vol. II, p. 91), qui expriment en ce sens le droit international général coutumier, précisent, à cet égard, qu’un traité doit être interprété de bonne foi, suivant le sens ordinaire à attribuer à ses termes dans leur contexte, et à la lumière de son objet et de son but (voir, en ce sens, arrêt du 10 janvier 2006, IATA et ELFAA, C‑344/04, EU:C:2006:10, point 40).
67 Il résulte du préambule de la convention unique que les parties se déclarent, notamment, soucieuses de la santé physique et morale de l’humanité ainsi que conscientes du devoir qui leur incombe de prévenir et de combattre la toxicomanie.
68 Aux termes de l’article 1er, paragraphe 1, sous j), de la convention unique, le terme « stupéfiant » désigne toute substance des tableaux I et II de cette convention, qu’elle soit naturelle ou synthétique. Figurent au tableau I de ladite convention, notamment, le cannabis, la résine de cannabis ainsi que les extraits et teintures de cannabis.
69 En outre, les termes « cannabis » et « plante de cannabis » sont définis à l’article 1er, paragraphe 1, sous b) et c), de la convention unique, respectivement, comme « les sommités florifères ou fructifères de la plante de cannabis (à l’exclusion des graines et des feuilles qui ne sont pas accompagnées des sommités) dont la résine n’a pas été extraite, quelle que soit leur application », et comme « toute plante du genre cannabis ».
70 En l’occurrence, il ressort des éléments du dossier dont dispose la Cour que le CBD en cause au principal est extrait de la plante cannabis sativa dans son intégralité et non pas, seulement, des graines et des feuilles de cette plante à l’exclusion de ses sommités florifères ou fructifères.
71 Dans ces conditions, il est vrai qu’une interprétation littérale des dispositions de la convention unique pourrait induire la conclusion que, en tant que le CBD est extrait d’une plante du genre cannabis et que cette plante est utilisée dans son intégralité, y compris ses sommités florifères ou fructifères, celui-ci constitue un extrait de cannabis, au sens du tableau I de cette convention et, par conséquent, un « stupéfiant », au sens de l’article 1er, paragraphe 1, sous j), de ladite convention.
72 Toutefois, il importe de relever qu’il découle des éléments du dossier dont dispose la Cour et qui sont résumés au point 34 du présent arrêt que le CBD en cause au principal n’apparaît pas avoir d’effet psychotrope et d’effet nocif sur la santé humaine sur la base des données scientifiques disponibles. D’ailleurs, selon ces éléments du dossier, la variété de cannabis dont cette substance a été extraite, qui a été légalement cultivée en République tchèque, a une teneur en THC n’excédant pas 0,2 %.
73 Or, ainsi qu’il ressort du point 67 du présent arrêt, la convention unique est fondée, notamment, sur un but de protection de la santé physique et morale de l’humanité. Il convient, par conséquent, de tenir compte de ce but dans l’interprétation des dispositions de cette convention.
74 Une telle approche s’impose d’autant plus qu’une lecture des commentaires sur la convention unique publiés par l’Organisation des nations unies afférents à la définition du « cannabis » aux fins de cette convention induit la conclusion que, eu égard au but et à l’esprit général de ladite convention, cette définition est intrinsèquement liée à l’état de la connaissance scientifique quant à la nocivité des produits dérivés du cannabis sur la santé humaine. À titre d’illustration, il ressort, ainsi, en particulier, de ces commentaires que l’exclusion de la définition du cannabis, figurant à l’article 1er, paragraphe 1, sous b), de la même convention, des sommités florifères ou fructifères dont la résine a été extraite était justifiée par la circonstance que ces sommités ne contiennent qu’une quantité tout à fait négligeable du principe psychoactif.
75 Au vu de ces éléments, qu’il appartient à la juridiction de renvoi de vérifier, il y a lieu de considérer que, le CBD ne comportant pas de principe psychoactif en l’état actuel des connaissances scientifiques rappelées au point 34 du présent arrêt, il serait contraire au but et à l’esprit général de la convention unique d’inclure celui-ci dans la définition des « stupéfiants », au sens de cette convention, en tant qu’extrait de cannabis.
76 Il s’ensuit que le CBD en cause au principal ne constitue pas un stupéfiant, au sens de la convention unique.
77 Par ailleurs, il importe encore d’ajouter que, ainsi que la Commission l’a également relevé, le CBD en cause au principal a été légalement produit et commercialisé en République tchèque.
78 À la lumière de l’ensemble des considérations qui précèdent, il y a lieu de conclure que les articles 34 et 36 TFUE sont applicables au CBD en cause au principal.
79 À cet égard, il convient de rappeler que la libre circulation des marchandises entre les États membres est un principe fondamental du traité FUE qui trouve son expression dans l’interdiction, énoncée à l’article 34 TFUE, des restrictions quantitatives à l’importation entre les États membres ainsi que de toutes mesures d’effet équivalent (arrêt du 18 juin 2019, Autriche/Allemagne, C‑591/17, EU:C:2019:504, point 119).
80 Selon une jurisprudence constante, l’interdiction des mesures d’effet équivalent à des restrictions quantitatives à l’importation édictée à l’article 34 TFUE vise toute mesure des États membres susceptible d’entraver directement ou indirectement, actuellement ou potentiellement, le commerce à l’intérieur de l’Union (arrêt du 18 juin 2019, Autriche/Allemagne, C‑591/17, EU:C:2019:504, point 120).
81 Par ailleurs, une mesure, même si elle n’a ni pour objet ni pour effet de traiter moins favorablement des produits en provenance d’autres États membres, relève également de la notion de « mesure d’effet équivalent à des restrictions quantitatives », au sens de l’article 34 TFUE, si elle entrave l’accès au marché d’un État membre des produits originaires d’autres États membres (arrêt du 18 juin 2019, Autriche/Allemagne, C‑591/17, EU:C:2019:504, point 121).
82 En l’occurrence, il n’est pas contesté que l’interdiction de commercialiser le CBD légalement produit dans un autre État membre, lorsqu’il est extrait de la plante de cannabis sativa dans son intégralité, et non de ses seules fibres et graines, constitue une mesure d’effet équivalent à des restrictions quantitatives, au sens de l’article 34 TFUE.
83 Cependant, il ressort d’une jurisprudence constante qu’une telle mesure peut être justifiée par l’une des raisons d’intérêt général énumérées à l’article 36 TFUE ou par des exigences impératives. Dans l’un et l’autre cas, la disposition nationale doit être propre à garantir la réalisation de l’objectif poursuivi et ne pas aller au-delà de ce qui est nécessaire pour qu’il soit atteint (arrêt du 18 juin 2019, Autriche/Allemagne, C‑591/17, EU:C:2019:504, point 122).
84 Par ailleurs, une mesure restrictive ne saurait être considérée comme propre à garantir la réalisation de l’objectif recherché que si elle répond véritablement au souci de l’atteindre d’une manière cohérente et systématique (arrêt du 23 décembre 2015, Scotch Whisky Association e.a., C‑333/14, EU:C:2015:845, point 37).
85 Dans la mesure où la République française fait valoir que sa réglementation interdisant la commercialisation des produits issus des parties de la plante de cannabis autres que ses fibres et graines vise la protection de la santé publique figurant à l’article 36 TFUE, il y a lieu de rappeler que la santé et la vie des personnes occupent le premier rang parmi les biens et les intérêts protégés par le traité FUE et qu’il appartient aux États membres de décider du niveau auquel ils entendent assurer la protection de la santé publique ainsi que de la manière dont ce niveau doit être atteint. Celui-ci pouvant varier d’un État membre à l’autre, il convient de reconnaître aux États membres une marge d’appréciation (arrêt du 19 octobre 2016, Deutsche Parkinson Vereinigung, C‑148/15, EU:C:2016:776, point 30).
86 Un tel pouvoir d’appréciation relatif à la protection de la santé publique est particulièrement important lorsqu’il est démontré que des incertitudes subsistent en l’état actuel de la recherche scientifique quant à certaines substances utilisées par les consommateurs (voir, en ce sens, arrêt du 28 janvier 2010, Commission/France, C‑333/08, EU:C:2010:44, point 86).
87 L’article 36 TFUE prévoyant une exception, d’interprétation stricte, à la libre circulation des marchandises à l’intérieur de l’Union, il incombe aux autorités nationales qui l’invoquent de démontrer dans chaque cas d’espèce, compte tenu des résultats de la recherche scientifique internationale, que leur réglementation est nécessaire pour protéger effectivement les intérêts visés à cette disposition et, notamment, que la commercialisation des produits en question présente un risque réel pour la santé publique qui doit être évalué d’une manière approfondie (arrêt du 28 janvier 2010, Commission/France, C‑333/08, EU:C:2010:44, points 87 et 88).
88 Une décision d’interdire la commercialisation, qui constitue, d’ailleurs, l’entrave la plus restrictive aux échanges concernant les produits légalement fabriqués et commercialisés dans d’autres États membres, ne saurait être adoptée que si le risque réel allégué pour la santé publique apparaît comme suffisamment établi sur la base des données scientifiques les plus récentes qui sont disponibles à la date de l’adoption d’une telle décision. Dans un tel contexte, l’évaluation du risque que l’État membre est tenu d’effectuer a pour objet l’appréciation du degré de probabilité des effets néfastes de l’emploi des produits interdits pour la santé humaine et de la gravité de ces effets potentiels (arrêt du 28 janvier 2010, Commission/France, C‑333/08, EU:C:2010:44, point 89).
89 En exerçant leur pouvoir d’appréciation relatif à la protection de la santé publique, les États membres doivent respecter le principe de proportionnalité. Les moyens qu’ils choisissent doivent par conséquent être limités à ce qui est effectivement nécessaire pour assurer la sauvegarde de la santé publique, ils doivent être proportionnés à l’objectif ainsi poursuivi, lequel n’aurait pas pu être atteint par des mesures restreignant d’une manière moindre les échanges intracommunautaires (arrêt du 28 janvier 2010, Commission/France, C‑333/08, EU:C:2010:44, point 90).
90 Certes, l’évaluation que l’État membre est tenu d’effectuer pourrait révéler un grand degré d’incertitude scientifique et pratique à cet égard. Une telle incertitude, indissociable de la notion de précaution, influe sur l’étendue du pouvoir d’appréciation de l’État membre et se répercute ainsi sur les modalités d’application du principe de proportionnalité. Dans de telles circonstances, il doit être admis qu’un État membre peut, en vertu du principe de précaution, prendre des mesures de protection sans avoir à attendre que la réalité et la gravité de ces risques soient pleinement démontrées. Toutefois, l’évaluation du risque ne peut se fonder sur des considérations purement hypothétiques (arrêt du 28 janvier 2010, Commission/France, C‑333/08, EU:C:2010:44, point 91).
91 Une application correcte du principe de précaution présuppose, en premier lieu, l’identification des conséquences potentiellement négatives pour la santé de l’utilisation proposée du produit dont la commercialisation est interdite et, en second lieu, une évaluation compréhensive du risque pour la santé fondée sur les données scientifiques disponibles les plus fiables et les résultats les plus récents de la recherche internationale (arrêt du 28 janvier 2010, Commission/France, C‑333/08, EU:C:2010:44, point 92).
92 Lorsqu’il s’avère impossible de déterminer avec certitude l’existence ou la portée du risque allégué en raison de la nature insuffisante, non concluante ou imprécise des résultats des études menées, mais que la probabilité d’un dommage réel pour la santé publique persiste dans l’hypothèse où le risque se réaliserait, le principe de précaution justifie l’adoption de mesures restrictives, sous réserve qu’elles soient non discriminatoires et objectives (arrêt du 28 janvier 2010, Commission/France, C‑333/08, EU:C:2010:44, point 93).
93 Certes, c’est au regard de la jurisprudence citée aux points 83 à 92 du présent arrêt qu’il appartient à la juridiction de renvoi d’apprécier si l’interdiction de commercialiser le CDB légalement produit dans un autre État membre, lorsqu’il est extrait de la plante de cannabis sativa dans son intégralité et non de ses seules fibres et graines, est propre à garantir la réalisation de l’objectif de la protection de la santé publique et ne va pas au-delà de ce qui est nécessaire pour qu’il soit atteint. Toutefois, il incombe à la Cour de lui fournir toutes les indications nécessaires afin de la guider dans cette appréciation.
94 En ce qui concerne l’appréciation de la question de savoir si cette interdiction est propre à garantir la réalisation de l’objectif de la protection de la santé publique, il y a lieu de relever qu’il est apparu, lors de l’audience, que ladite interdiction ne frapperait pas la commercialisation du CBD de synthèse qui aurait les mêmes propriétés que le CBD extrait de la plante de cannabis sativa dans son intégralité et qui pourrait être utilisé comme substitut à ce dernier. Il appartient à la juridiction de renvoi de vérifier cette circonstance qui, si elle était avérée, serait de nature à indiquer que la réglementation au principal n’est pas propre à atteindre, de manière cohérente et systématique, cet objectif.
95 S’agissant de la nécessité de l’interdiction de commercialiser le CBD lorsque ce dernier est extrait de la plante de cannabis sativa dans son intégralité et non de ses seules fibres et graines, il convient d’indiquer que la République française n’est pas tenue de démontrer que la propriété dangereuse d’un tel produit est identique à celle des stupéfiants tels que les substances figurant aux tableaux I et II de la convention unique. Il n’en demeure pas moins qu’il appartient à la juridiction de renvoi d’apprécier les données scientifiques disponibles et produites devant elle afin de s’assurer, à la lumière de la jurisprudence citée aux points 88 à 92 du présent arrêt et compte tenu des considérations formulées au point 72 de cet arrêt, que le risque réel allégué pour la santé publique n’apparaît pas comme étant fondé sur des considérations purement hypothétiques.
96 Eu égard à l’ensemble des considérations qui précèdent, il convient de répondre à la question posée que les articles 34 et 36 TFUE doivent être interprétés en ce sens qu’ils s’opposent à une réglementation nationale interdisant la commercialisation du CBD légalement produit dans un autre État membre, lorsqu’il est extrait de la plante de cannabis sativa dans son intégralité et non de ses seules fibres et graines, à moins que cette réglementation soit propre à garantir la réalisation de l’objectif de la protection de la santé publique et n’aille pas au-delà de ce qui est nécessaire pour qu’il soit atteint. Les règlements nos 1307/2013 et 1308/2013 doivent être interprétés en ce sens qu’ils ne s’appliquent pas à une telle réglementation.
Sur les dépens
97 La procédure revêtant, à l’égard des parties au principal, le caractère d’un incident soulevé devant la juridiction de renvoi, il appartient à celle-ci de statuer sur les dépens. Les frais exposés pour soumettre des observations à la Cour, autres que ceux desdites parties, ne peuvent faire l’objet d’un remboursement.
Par ces motifs, la Cour (quatrième chambre) dit pour droit :
Les articles 34 et 36 TFUE doivent être interprétés en ce sens qu’ils s’opposent à une réglementation nationale interdisant la commercialisation du cannabidiol (CBD) légalement produit dans un autre État membre, lorsqu’il est extrait de la plante de cannabis sativa dans son intégralité et non de ses seules fibres et graines, à moins que cette réglementation soit propre à garantir la réalisation de l’objectif de la protection de la santé publique et n’aille pas au-delà de ce qui est nécessaire pour qu’il soit atteint. Le règlement (UE) no 1307/2013 du Parlement européen et du Conseil, du 17 décembre 2013, établissant les règles relatives aux paiements directs en faveur des agriculteurs au titre des régimes de soutien relevant de la politique agricole commune et abrogeant le règlement (CE) no 637/2008 du Conseil et le règlement (CE) no 73/2009 du Conseil, et le règlement (UE) n° 1308/2013 du Parlement européen et du Conseil, du 17 décembre 2013, portant organisation commune des marchés des produits agricoles et abrogeant les règlements (CEE) no 922/72, (CEE) no 234/79, (CE) no 1037/2001 et (CE) no 1234/2007 du Conseil, doivent être interprétés en ce sens qu’ils ne s’appliquent pas à une telle réglementation.